น้ำยากัดกระจก ส่วนผสม | ||||
วิธีทำ นำน้ำ 1 กก. ใส่ในภาชนะพลาสติก จากนั้นค่อยๆรินกรดไฮโดรฟลูออริคใส่ลงไปอย่างช้าๆพร้อม กับคนไปด้วย จนหมดแล้ว บรรจุใส่ขวดพลาสติคจนกว่าจะใช้งาน ตัวนี้ถ้าไม่จำเป็นหรือไม่ถนัดทางสารเคมีไม่แนะนำให้ทำเพราะกรดกัดแก้วกัดกร่อนรุนแรงห้ามเด็กทำเด็ดขาด ถ้าจะทำมีข้อควรระวังดังนี้ 1. เวลาทำควรสวมถุงมือยาง แว่นตา ปิดจมูกทุกครั้ง 2. การผสมเคมีใช้วิธีเติมกรดลงในน้ำ ห้าม !!!! เติมน้าลงในกรด 3. สถานที่ทำงานควรเป็นที่โปร่งโล่ง อากาศถ่ายเทสะดวก |
คลังบทความ
30 ส.ค. 2554
น้ำยากัดกระจก
สารละลายกรด - เบส
สารละลายกรด-เบส
สารละลายกรดสารละลายกรด (acid solution) คือ สารละลายที่กรดละลายในน้ำ (กรดเป็นตัวละลาย น้ำเป็นตัวทำละลาย) ซึ่งสามารถแตกตัวให้ไฮโดรเจนไอออน (H
สมบัติของสารละลายกรด
สมบัติของสารละลายกรด มีดังนี้
1. มีรสเปรี้ยว เช่น น้ำมะนาว (กรดซิตริก) น้ำส้มสายชู (กรดแอซีติก) วิตามินซี (กรดแอสคอร์บิก) เป็นต้น
2. ทดสอบโดยการใช้กระดาษลิตมัส (มี 2 สี คือ สีแดงและสีน้ำเงิน) ถ้าใช้กระดาษลิตมัสสีน้ำเงินจะเกิดการเปลี่ยนแปลงสีของ กระดาษลิตมัสจากสีน้ำเงินเป็นสีแดง แต่ถ้าใช้กระดาษลิตมัสสีแดงจะไม่มีการเปลี่ยนแปลงสีของกระดาษลิตมัส
รูปแสดงกระดาษลิตมัส |
ปฏิกิริยาของโลหะสังกะสีในกรดเกลือ ได้เกลือซิงค์คลอไรด์ (ZnCl2) กับแก๊สไฮโดรเจน
โลหะที่เกิดปฏิกิริยา เช่น สังกะสี (Zn), แมกนีเซียม (Mg), ทองแดง (Cu), เงิน (Ag), อะลูมิเนียม (Al) เป็นต้น
4. ทำปฏิกิริยากับสารประกอบคาร์บอเนต (XCO3; X คือ ธาตุโลหะใดๆ เช่น หินปูน (CaCO3), โซเดียมไฮโดรเจนคาร์บอเนต (NaHCO3) หรือผงฟู ได้แก๊สคาร์บอนไดออกไซด์ (CO2) เสมอ เช่น
ปฏิกิริยาของหินปูนกับกรดเกลือ ดังสมการ
เมื่อ ( ) เป็นการบอกสถานะของสารในปฏิกิริยา
- (s) = solid = ของแข็ง
- (l) = liquid = ของเหลว
- (g) = gas = แก๊ส
ข้อควรทราบ
- กรดทำปฏิกิริยากับโลหะได้แก๊สไฮโดรเจน (H2)
- กรดทำปฏิกิริยากับสารประกอบคาร์บอเนตได้แก๊สคาร์บอนไดออกไซด์ (CO2) เสมอ
5. สารละลายกรดสามารถนำไฟฟ้าได้
6. ทำปฏิกิริยากับเบสได้เกลือและน้ำ
ประเภทของกรด
กรดแบ่งเป็น 2 ประเภทใหญ่ๆ คือ
1. กรดอินทรีย์ เป็นกรดที่ได้จากสิ่งมีชีวิต มักพบในพืชหรือสัตว์ เพราะมีต้นกำเนิดมาจากสิ่งมีชีวิตนั่นเอง
เช่น
- HCOOH กรดฟอร์มิก (กรดมด) แหล่งที่พบ เช่น มดแดง เป็นต้น
- CH3COOH กรดแอซีติก (กรดน้ำส้ม) แหล่งที่พบ เช่น น้ำส้มสายชู เป็นต้น
- C6H8O7 กรดซิตริก แหล่งที่พบ เช่น ส้ม มะนาว เป็นต้น
- C6H8O6 กรดแอสคอร์บิก แหล่งที่พบ เช่น ส้ม มะนาว ฝรั่ง มะขามป้อม เป็นต้น
- C3H6O3กรดแลกติก แหล่งที่พบ เช่น น้ำนม เป็นต้น
- C14H10O9 กรดแทนนิก แหล่งที่พบ เช่น ชา เป็นต้น
2. กรดอนินทรีย์ (กรดแร่ธาตุ) เป็นกรดที่เกิดจากแร่ธาตุ ไม่ได้มาจากสิ่งมีชีวิต ดังนั้นอำนาจการกัดกร่อนจึงสูงกว่ากรดอินทรีย์ และบางชนิดก็เป็นกรดแก่ ซึ่งมีอำนาจการกัดกร่อนสูง
เช่น
- H2SO4 กรดซัลฟิวริก (กรดกำมะถัน) แหล่งที่พบ เช่น ผงซักฟอก ปุ๋ย แบตเตอรี่รถยนต์ เป็นต้น
- HCl กรดไฮโดรคลอริก (กรดเกลือ) แหล่งที่พบ เช่น น้ำยาล้างห้องน้ำ อยู่ในกระเพาะอาหารของมนุษย์ เป็นต้น
- H2CO3 กรดคาร์บอนิก แหล่งที่พบ เช่น น้ำโซดา น้ำอัดลม เป็นต้น
สารละลายเบส
สารละลายเบส (base solution) คือ สารละลายที่เบสละลายในน้ำ (เบสเป็นตัวละลาย น้ำเป็นตัวทำละลาย) ซึ่งสามารถแตกตัวให้ไฮดรอกไซด์ไอออน (OH
สมบัติของสารละลายเบส
สมบัติของสารละลายเบส มีดังนี้
1. มีรสฝาด ขม
2. เมื่อสัมผัสจะลื่นมือ
3. ทดสอบกับกระดาษลิตมัส ถ้าใช้กระดาษลิตมัสสีแดงจะเกิดการเปลี่ยนแปลงสีของกระดาษลิตมัสจากสีแดงป็นสีน้ำเงิน แต่ถ้าใช้กระดาษลิตมัสสีน้ำเงินจะไม่มีการเปลี่ยนแปลงสีของกระดาษลิตมัส
4. ทำปฏิกิริยากับเกลือแอมโมเนีย (NH4Y; Y = ธาตุโลหะ เช่น คลอรีน (Cl) ได้เป็นแอมโมเนียมคลอไรด์ (NH4Cl) จะได้น้ำและแอมโมเนีย (NH3) เป็นผลิตภัณฑ์เสมอ เช่น
# ปฏิกิริยาของด่างคลี (NaOH, โซเดียมไฮดรอกไซด์) กับเกลือแอมโมเนียมคลอไรด์
5. ไม่ทำปฏิกิริยากับโลหะ ยกเว้น อะลูมิเนียม (Al) ที่เมื่อทำปฏิกิริยาแล้วจะได้แก๊สไฮโดรเจน (H2)
6. ผสมกับน้ำมันหรือไขมัน จะได้สบู่และกลีเซอรอล เรียกปฏิกิริยานี้ว่า ปฏิกิริยาการเกิดสบู่ (saponification reaction)
7. สารละลายเบสนำไฟฟ้าได้
8. ทำปฏิกิริยากับกรดได้เกลือและน้ำ
ค่า pH ของสารละลายกรด - เบส
pH มาจาก potential of hydrogen ion ซึ่งสามารถใช้บอกความเป็นกรด-เบสของสารละลายได้ ซึ่งค่า pH มีความสัมพันธ์กับความเข้มข้นของไฮโดรเนียมไอออน (H3O
# pH = 7 สารละลายมีสมบัติเป็นกลาง
# pH > 7 สารละลายมีสมบัติเป็นเบส ยิ่งมี pH มาก ยิ่งเป็นเบสที่แรงขึ้น
# pH < 7 สารละลายมีสมบัติเป็นกรด ยิ่งมี pH น้อย ยิ่งเป็นกรดที่แรงขึ้น
ตัวอย่าง กำหนดให้ สารละลาย A มีค่า pH = 9 สารละลาย B มีค่า pH = 8 สารละลาย C มีค่า pH = 3 สารละลาย D มีค่า pH = 5 จากสารละลาย A, B, C และ D สามารถสรุปได้อย่างไร
- ระหว่างสารละลาย A กับสารละลาย B พบว่าสารละลาย A เป็นเบสที่แรงกว่าสารละลาย B (pH มากกว่า)
- ระหว่างสารละลาย C กับสารละลาย D พบว่าสารละลาย C เป็นกรดแรงกว่าสารละลาย D (pH น้อยกว่า) ตอบ
สารละลายกรด-เบสในชีวิตประจำวัน
ชีวิตประจำวันในปัจจุบัน เราได้ใช้สารต่างๆ ที่มีสมบัติเป็นกรด-เบสทั้งทางตรงและทางอ้อม ซึ่งใช้ในการเป็นยารักษาโรค (ยาลดกรดในกระเพาะอาหาร) กำจัดสิ่งสกปรก (สบู่ ผงซักฟอก) ปรุงอาหาร (น้ำส้มสายชู) นอกจากนี้ ในร่างกายก็ประกอบด้วยสารที่มีสมบัติเป็นกรด-เบส เช่น กรดเกลือในกระเพาะอาหาร น้ำดีจากตับ มีสมบัติเป็นเบส เป็นต้น สารที่มีสมบัติเป็นกรด-เบสในชีวิตประจำวัน เช่น
1. สารทำความสะอาดเครื่องสุขภัณฑ์ ซึ่งมักมีส่วนประกอบของกรดเกลือหรือกรดไฮโดรคลอริก (HCl) กรดไนตริก (HNO3) ซึ่งมีสมบัติเป็นกรด กรดมีสมบัติในการทำปฏิกิริยากับแผ่นกระเบื้องพื้นห้องน้ำ ทำให้เกิดการสึกกร่อน ทำให้สิ่งสกปรกหลุดออกจากพื้นและสุขภัณฑ์ต่างๆ ได้ ปฏิกิริยาที่เกิดขึ้นดังสมการ
การใช้น้ำยาล้างห้องน้ำที่มีส่วนประกอบของกรดเกลือ (HCl) นี้ต้องใช้อย่างระมัดระวัง เพราะเกิดแก๊สที่เป็นพิษเข้าสู่หลอดลม เป็นอันตรายต่อระบบทางเดินหายใจ
2. สารปรุงแต่งอาหาร มีทั้งที่มีสมบัติเป็นกรดและเบส เช่น
- สารปรุงแต่งอาหารที่มีสมบัติเป็นกรด เช่น กรดแอซีติกในน้ำส้มสายชู กรดซิตริกในน้ำมะนาว น้ำมะขาม กรดแอสคอร์บิกในวิตามินซี เป็นต้น
- สารปรุงแต่งอาหารที่มีสมบัติเป็นเบส เช่น น้ำปูนใส (Ca(OH)2), น้ำขี้เถ้า (NaOH), ผงฟู (NaHCO3) เป็นต้น
3. สารในภาคเกษตรกรรม ได้แก่ ปุ๋ย ซึ่งมีทั้งที่มีสมบัติเป็นกรดและเบส เช่น
- ปุ๋ยที่มีสมบัติเป็นกรด เช่น ปุ๋ยแอมโมเนียมซัลเฟต ((NH4)2SO4) ปุ๋ยแอมโมเนียมคลอไรด์ (NH4Cl) เป็นต้น
- ปุ๋ยที่มีสมบัติเป็นเบส เช่น ปุ๋ยยูเรีย (NH2CONH2) ปุ๋ยแอมโมเนีย (NH3) เป็นต้น
4. ยาลดกรดในกระเพาะอาหาร จะมีส่วนประกอบที่มีสมบัติเป็นเบสอ่อน เช่น โซเดียมไฮโดรเจนคาร์บอเนต (NaHCO3), แคลเซียมคาร์บอเนต (CaCO3), แมกนีเซียมไฮดรอกไซด์ (Mg (OH)2, อะลูมิเนียมไฮดรอกไซด์ (Al2O3) โดยสารละลายนี้จะไปทำปฏิกิริยากับกรด ซึ่งจะปรับสภาพความเป็นกรดในกระเพาะอาหารให้ลดลงได้
ข้อควรทราบ
1. ยาลดกรดที่ประกอบด้วย Mg(OH)2 และ MgCO3 จะเป็นยาระบายแก้ท้องผูก
2. ยาลดกรดทีมี MgCO3และ NaHCO3จะทำให้เกิดแก๊สในกระเพาะอาหารทำให้ท้องอืด ท้องเฟ้อ
3. ยาลดกรดที่มีหินปูน (CaCO3) อาจทำให้เกิดอาการท้องผูก รวมทั้งอาจก่อให้เกิดโรคนิ่วได้
5. สารที่ใช้ทำความสะอาด เช่น สบู่ ผงซักฟอก เป็นต้น ประกอบด้วยสารที่มีสมบัติเป็นเบส
# สบู่ คือ เกลือโซเดียมหรือโพแทสเซียมของกรดไขมัน ผลิตหรือเตรียมได้จากน้ำมันหรือไขมันกับเบส โซเดียมไฮดรอกไซด์ (NaOH) หรือ โพแทสเซียมไฮดรอกไซด์ (KOH)
รูปแสดงโครงสร้างของสบู่ |
สบู่สามารถชำระล้างสิ่งสกปรกได้ โดยหันปลายข้างที่ไม่มีขั้วไปละลายคราบไขมัน ส่วนด้านที่มีขั้วหันเข้าหาน้ำ ทำให้คราบไขมันแตกตัวและถูกล้อมรอบด้วยโมเลกุลของสบู่ ทำให้คราบไขมันนั้นหลุดออกจากผิวได้
# ผงซักฟอก คือ เกลือโซเดียมซัลโฟเนตของกรดไขมัน มีโครงสร้าง 2 ส่วน ได้แก่ ส่วนที่มีขั้วและไม่มีขั้ว จัดเป็นสารลดแรงตึงผิว
ข้อควรทราบ
สารลดแรงตึงผิวทำให้ช่วยขจัดคราบไขมัน สิ่งสกปรกออกจากเสื้อผ้าได้
การทำความสะอาดของสบู่จะแตกต่างจากผงซักฟอกในน้ำกระด้าง (น้ำที่มีองค์ประกอบของแคลเซียมไอออน และแมกนีเซียมไอออน) ซึ่งผงซักฟอกสามารถทำความสะอาดได้ในน้ำกระด้าง แต่สบู่เกิดคราบไคลสบู่ขึ้นทำให้ฟองน้อย ประสิทธิภาพการทำความสะอาดต่ำ
1. ใช้สารละลายเบเนดิกต์ ทดสอบน้ำตาลโมเลกุลเล็ก ๆ ดังนี้
กลูโคส | + | สารละลายเบเนดิกต์ | ได้ ตะกอนสีแดงอิฐ | |
ซูโคส | + | สารละลายเบเนดิกต์ | ได้ สารละลายสีเขียวอมเหลือง |
2. ใช้สารละลายไอโอดีน ทดสอบทดสอบคาร์โบไฮเดรตที่มีโมเลกุลใหญ่ ดังนี้
แป้ง | + | สารละลายไอโอดีน | ได้ | สีน้ำเงินเข้ม |
ไกลโคเจน | + | สารละลายไอโอดีน | ได้ | สีน้ำตาลแกมแดง |
เซลลูโลส | + | สารละลายไอโอดีน | ได้ | ไม่พบการเปลี่ยนแปลงใด ๆ |
ข้อควรจำ
สารละลายเบเนดิกต์จะไม่ทำปฏิกิริยากับน้ำตาลซูโครส แต่จะทำปฏิกิริยากับน้ำตาลโมเลกุลเดี่ยว และน้ำตาลโมเลกุลคู่บางชนิด เช่น มอลโทส แล็กโทส
การกลั่น
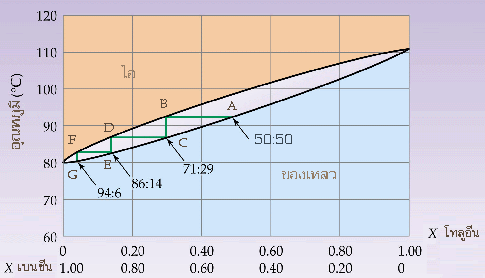
5.1 การกลั่นแบบธรรมดา (normal distillation) การกลั่นเป็นการแยกของเหลวที่สามารถระเหยได้ ซึ่งมีองค์ประกอบตั้งแต่ 2 ขึ้นไป การกลั่นแบบธรรมดาเหมาะสำหรับใช้กลั่นของผสมในของเหลวที่มี จุดเดือด (boiling point) แตกต่างกันมาก ๆ 5.2 การกลั่นลำดับส่วน (fractional distillation) การกลั่นลำดับส่วนเป็นวิธีการแยกของเหลวที่สามารถระเหยได้ตั้งแต่ 2 ชนิดขึ้นไป มีหลักการเช่นเดียวกันกับการกลั่นแบบธรรมดา คือเพื่อต้องการแยกองค์ประกอบในสารละลายให้ออกจากกัน แต่ก็จะมีส่วนที่แตกต่างจากการกลั่นแบบธรรมดา คือ การกลั่นแบบกลั่นลำดับส่วนเหมาะสำหรับใช้กลั่นของเหลวที่เป็นองค์ประกอบของสารละลายที่จุดเดือดต่างกันน้อยๆ ในขั้นตอนของกระบวนการกลั่นลำดับส่วน จะเป็นการนำไอของแต่ละส่วนไปควบแน่น แล้วนำไปกลั่นซ้ำและควบแน่นไอเรื่อย ๆ ซึ่งเทียบได้กับเป็นการการกลั่นแบบธรรมดาหลาย ๆ ครั้งนั่นเอง ความแตกต่างของการกลั่นลำดับส่วนกับการกลั่นแบบธรรมดา จะอยู่ที่คอลัมน์ โดยคอลัมน์ของการกลั่นลำดับส่วนจะมีลักษณะเป็นชั้นซับซ้อน เป็นชั้นๆ ในขณะที่คอลัมน์แบบธรรมดาจะเป็นคอลัมน์ธรรมดา ไม่มีความซับซ้อนของคอลัมน์ ชุดอุปกรณ์การกลั่นลำดับส่วน นอกจากนี้ ในการกลั่นแบบลำดับส่วน จะต้องมีการเพิ่มอุณหภูมิอย่างช้า ๆ ดังนั้น จำเป็นที่จะต้องมีอุปกรณ์ที่ให้ความร้อน (heater) และสามารถควบคุมอุณหภูมิได้ เพราะของผสมที่กลั่นแบบลำดับส่วนมักจะมีจุดเดือดที่ใกล้เคียงกัน ซึ่งตรงกันข้ามกับการกลั่นแบบธรรมดา ความร้อนที่ให้ไม่จำเป็นต้องควบคุมเหมือนการกลั่นลำดับส่วน แต่ก็ไม่ควรให้ความร้อนที่สูงเกินไป เพราะความร้อนที่สูงเกินไป อาจจะไปทำลายสารที่เราต้องการกลั่น เพราะฉะนั้น ประสิทธิภาพในการกลั่นลำดับส่วนจึงดีกว่าการกลั่นแบบธรรมดา 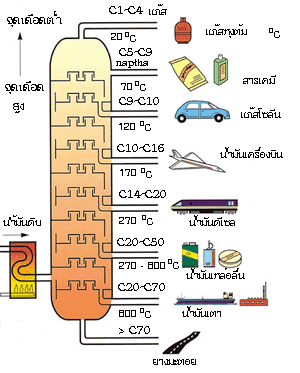 กระบวนการกลั่นลำดับส่วนที่นำมาใช้ในอุตสาหกรรมปิโตรเลียม ตัวอย่างการนำการกลั่นลำดับส่วนมาใช้ประโยชน์ เช่น การแยกของผสมระหว่างเบนซีน (benzene) กับโทลูอีน (toluene)
ปกติ เบนซีน กับ โทลูอีน เป็นสารที่ไม่มีสีทั้งคู่ แต่ที่นักเรียนมองเห็นเป็นสีเทา (เบนซีน) และสีน้ำตาล (โทลูอีน) ในขวดรูปกรวย ก็เพื่อต้องการให้นักเรียนพิจารณาปริมาณสารที่อยู่ในขวดชมพู่ควบคู่กับอัตราส่วนของเบนซีนที่แยกออกจากโทลูอีนในกราฟ ค่า X เป็นเศษส่วนโมล จากกราฟจะเห็นได้ว่า จุดเดือดของโทลูอีน (toluene) สูงกว่าเบนซีน (benzene) แสดงว่าความดันไอของโทลูอีน จะต่ำกว่าเบนซีน ถ้านำของผสมที่จุด A ซึ่งมีอัตราส่วนของเบนซีนต่อโทลูอีนเป็น 50: 50 มาให้ความร้อนจนกลายเป็นไอ ซึ่งของผสมจะเดือดที่ จุด B องค์ประกอบของไอที่จุด B จะมีอัตราส่วนของเบนซีนต่อโทลูอีนเป็น 71: 29 และถ้านำไอที่จุด B มาควบแน่นจะได้ของเหลวผสมที่จุด C แล้วให้ความร้อนจนกลายเป็นไอ ของเหลวผสมจะเดือดที่ จุด D องค์ประกอบของไอที่จุด D จะมีอัตราส่วนของเบนซีนต่อโทลูอีนเป็น 86 : 14 จะเห็นได้ว่าองค์ประกอบของเบนซีนที่อยู่ในไอเพิ่มมากขึ้น ถ้าทำซ้ำเช่นนี้ไปเรื่อย ๆ จะสามารถแยกเบนซีนออกมาเป็นไอบริสุทธิ์ได้ ส่วนของเหลวที่เหลือจะเป็นโทลูอีนที่บริสุทธิ์ เพราะฉะนั้น การกลั่นลำดับส่วนของสารละลายที่สมบูรณ์แบบ จะสามารถแยกองค์ประกอบของเหลวออกจากกันได้อย่างบริสุทธิ์ | ||||||||||||||
พอลิเมอร์

แบ่ง
แบ่ง







29 ส.ค. 2554
อะตอม
ประมาณ 400 ปีก่อนคริสตศักราช - เดโมคริตุส นำเสนอแนวความคิดแรกเกี่ยวกับอะตอม นักปรัชญากรีก เดโมคริตุส (Democritus) และ ลุยซิปปุส (Leucippus) ได้เสนอทฤษฎีแรกเกี่ยวกับอะตอม ว่า อะตอมแต่ละอะตอมนั้นมีรูปร่างแตกต่างกัน ในลักษณะเดียวกับก้อนหิน ซึ่งรูปร่างนี้เป็นตัวกำหนดคุณสมบัติของอะตอม
1803 - จอห์น ดัลตัน (John Dalton) - พิสูจน์ว่าอะตอมนั้นมีอยู่จริง
จอห์น ดัลตัน ได้พิสูจน์ว่าสสารประกอบขึ้นจากอะตอม แต่ก็ไม่ได้รู้ว่าอะตอมนั้นมีรูปร่างอย่างไร ซึ่งงานของดัลตันนี้ขัดแย้งกับ ทฤษฎีของการแบ่งแยกได้อย่างไม่สิ้นสุด (infinite divisibility) ซึ่งได้กล่าวว่า สสารนั้นสามารถถูกแบ่งเป็นส่วนย่อยได้เสมอ อย่างไม่สิ้นสุด
1897 - โจเซฟ จอห์น ทอมสัน (Joseph John Thomson) - ค้นพบอิเล็กตรอน
ความเชื่อที่ว่า อะตอม เป็นส่วนที่เล็กที่สุดของสาร นั้นคงอยู่จนกระทั่งได้มีการพิสูจน์ให้เห็นว่าอะตอมนั้นยังประกอบด้วยอนุภาคที่เล็กกว่า โดยทอมสัน นั้นเป็นผู้ค้นพบอิเล็กตรอน ซึ่งแสดงให้เห็นว่าอะตอมนั้นยังสามารถแบ่งแยกเป็นส่วนย่อยได้อีก
1898 - Marie und Pierre Curie - กัมมันตภาพรังสี
1900 - Ludwig Boltzmann - ทฤษฎีปรมาณู
1900 - Max Planck - ควอนตัม
1906 - เออร์เนสท์ รัทเธอร์ฟอร์ด (Ernest Rutherford) - นิวเคลียส
รัทเธอร์ฟอร์ดได้พิสูจน์ให้เห็นว่าอะตอมนั้นมี นิวเคลียสซึ่งมีประจุไฟฟ้าเป็นบวก
1913 - Niels Bohr - แบบจำลองแบบเป็นระดับชั้น
1929 - Ernest O. Lawrence - เครื่องเร่งอนุภาค ไซโคลตรอน (cyclotron)
1932 - Paul Dirac und David Anderson - แอนตี้แมทเทอร์
1964 - Murray
1995 - Eric Cornell und Carl Wieman - โบส-ไอน์สไตน์ คอนเดนเสท
2000 - CERN - โบซอนฮิกส์
2002 - Brookhaven - สารประหลาด
จอห์น ดอลตัน เป็นคนแรกที่เสนอแนวคิดเกี่ยวกับอะตอม สรุปว่า
1. สารประกอบด้วยอนุภาคขนาดเล็ก เรียกว่า อะตอม แบ่งแยกไม่ได้ และสร้างขึ้นหรือทำลายให้สูญหายไปไม่ได้
2. อะตอมของธาตุชนิดเดียวกัน จะมีมวลเท่ากัน มีสมบัติเหมือนกัน แต่จะแตกต่างจากอะตอมของธาตุอื่น ๆ

3. อะตอมของธาตุสองชนิดอาจรวมตัวกันด้วยอัตราส่วนต่าง ๆ กัน เกิดเป็นสารประกอบได้หลายชนิด
ทอมสัน ทำการทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซในหลอดรังสีแคโทด พบว่าไม่ว่าจะใช้ก๊าซใดบรรจุในหลอดหรือใช้โลหะใดเป็นแคโทด จะได้รังสีที่ประกอบด้วยอนุภาคที่มีประจุลบ พุ่งมาที่ฉากเรืองแสงเหมือนเดิม เมื่อคำนวณหาอัตราส่วนของประจุต่อมวล (e/m) ของอนุภาค จะได้ค่าคงที่ทุกครั้งเท่ากับ 1.76 x 108 คูลอมบ์ต่อกรัม สรุปว่า อะตอมทุกชนิดมีอนุภาคที่มีประจุลบเป็นองค์ประกอบ เรียกว่าอิเล็กตรอน

1. สารประกอบด้วยอนุภาคขนาดเล็ก เรียกว่า อะตอม แบ่งแยกไม่ได้ และสร้างขึ้นหรือทำลายให้สูญหายไปไม่ได้
2. อะตอมของธาตุชนิดเดียวกัน จะมีมวลเท่ากัน มีสมบัติเหมือนกัน แต่จะแตกต่างจากอะตอมของธาตุอื่น ๆ

3. อะตอมของธาตุสองชนิดอาจรวมตัวกันด้วยอัตราส่วนต่าง ๆ กัน เกิดเป็นสารประกอบได้หลายชนิด
ทอมสัน ทำการทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซในหลอดรังสีแคโทด พบว่าไม่ว่าจะใช้ก๊าซใดบรรจุในหลอดหรือใช้โลหะใดเป็นแคโทด จะได้รังสีที่ประกอบด้วยอนุภาคที่มีประจุลบ พุ่งมาที่ฉากเรืองแสงเหมือนเดิม เมื่อคำนวณหาอัตราส่วนของประจุต่อมวล (e/m) ของอนุภาค จะได้ค่าคงที่ทุกครั้งเท่ากับ 1.76 x 108 คูลอมบ์ต่อกรัม สรุปว่า อะตอมทุกชนิดมีอนุภาคที่มีประจุลบเป็นองค์ประกอบ เรียกว่าอิเล็กตรอน

หลอดรังสีแคโทดที่มีขั้วไฟฟ้าในหลอดเพิ่มอีกสองขั้วเพื่อทำให้เกิดสนามไฟฟ้า
3. โกลดชไตน์ ดัดแปลงหลอดรังสีแคโทด เมื่อเปลี่ยนชนิดของก๊าซ พบว่า อนุภาคที่มีประจะบวกมีอัตราส่วนของประจุ
ต่อมวลไม่คงที่ ถ้าใช้ก๊าซไฮโดรเจน จะได้อนุภาคบวกมีประจุเท่ากับประจุของอิเล็กตรอนจึงเรียกอนุภาคบวกว่า โปรตอน
4. มิลลิแกน ทำการทดลองหาค่าประจุของอิเล็กตรอน เท่ากับ 1.60 x 10-19 คูลอมบ์ และเมื่อนำไปคำนวณหามวล ของอิเล็กตรอน จะได้เท่ากับ 9.11 x 10-28 กรัม
5. รัทเทอร์ฟอร์ด, ไกเกอร์ และมาร์สเดน ยิงอนุภาคแอลฟาไปยังแผ่นทองคำบาง ๆ พบว่า อนุภาคส่วนใหญ่จะวิ่งเป็นเส้นตรงผ่านแผ่นทองคำ นาน ๆ ครั้งจะเบนไปจากแนวเส้นตรง และน้อยครั้งมากที่อนุภาคจะสะท้อนกลับมากระทบฉากบริเวณหน้าแผ่นทองคำ
6. เลขอะตอม คือ ตัวเลขที่แสดงจำนวนโปรตอน
7. เลขมวล คือ ผลรวมของจำนวนโปรตอนและนิวตรอน
8. ไอโซโทป คือ อะตอมต่าง ๆ ของธาตุเดียวกันที่มีเลขมวลต่าง ๆ เช่น 11H, 21H และ 31H
9. สัญลักษณ์นิวเคลียร์ วิธีเขียน เลขอะตอมไว้มุมล่างซ้าย และเลขมวลไว้มุมบนซ้ายของสัญลักษณ์ เช่น 23 11 Na
10. การจัดอิเล็กตรอนในอะตอม วิธีการใช้ในการหาข้อมูลเกี่ยวกับตำแหน่งของอิเล็กตรอนรอบนิวเคลียส คือ การศึกษาสเปกตรัมของสารหรือธาตุแสงเป็นคลื่นแม่เหล็กไฟฟ้า แสงที่มองเห็นได้มีความยาวคลื่น400 - 700 นาโนเมตร แสงสีต่าง ๆ ในแถบสเปกตรัมของแสงได้แก่ ม่วง น้ำเงิน เขียว เหลือง ส้ม แดง
ต่อมวลไม่คงที่ ถ้าใช้ก๊าซไฮโดรเจน จะได้อนุภาคบวกมีประจุเท่ากับประจุของอิเล็กตรอนจึงเรียกอนุภาคบวกว่า โปรตอน
4. มิลลิแกน ทำการทดลองหาค่าประจุของอิเล็กตรอน เท่ากับ 1.60 x 10-19 คูลอมบ์ และเมื่อนำไปคำนวณหามวล ของอิเล็กตรอน จะได้เท่ากับ 9.11 x 10-
5. รัทเทอร์ฟอร์ด, ไกเกอร์ และมาร์สเดน ยิงอนุภาคแอลฟาไปยังแผ่นทองคำบาง ๆ พบว่า อนุภาคส่วนใหญ่จะวิ่งเป็นเส้นตรงผ่านแผ่นทองคำ นาน ๆ ครั้งจะเบนไปจากแนวเส้นตรง และน้อยครั้งมากที่อนุภาคจะสะท้อนกลับมากระทบฉากบริเวณหน้าแผ่นทองคำ
6. เลขอะตอม คือ ตัวเลขที่แสดงจำนวนโปรตอน
7. เลขมวล คือ ผลรวมของจำนวนโปรตอนและนิวตรอน
8. ไอโซโทป คือ อะตอมต่าง ๆ ของธาตุเดียวกันที่มีเลขมวลต่าง ๆ เช่น 11H, 21H และ 31H
9. สัญลักษณ์นิวเคลียร์ วิธีเขียน เลขอะตอมไว้มุมล่างซ้าย และเลขมวลไว้มุมบนซ้ายของสัญลักษณ์ เช่น 23 11 Na
10. การจัดอิเล็กตรอนในอะตอม วิธีการใช้ในการหาข้อมูลเกี่ยวกับตำแหน่งของอิเล็กตรอนรอบนิวเคลียส คือ การศึกษาสเปกตรัมของสารหรือธาตุแสงเป็นคลื่นแม่เหล็กไฟฟ้า แสงที่มองเห็นได้มีความยาวคลื่น400 - 700 นาโนเมตร แสงสีต่าง ๆ ในแถบสเปกตรัมของแสงได้แก่ ม่วง น้ำเงิน เขียว เหลือง ส้ม แดง
แสงสีม่วง มีความยาวคลื่นสั้นที่สุด แต่มีความถี่สูงที่สุด และมีพลังงานสูงสุดแสงสีแดง มีความยาวคลื่นมากที่สุด แต่มีความถี่ต่ำที่สุด และมีพลังงานต่ำสุด มักซ์ พลังค์ สรุปว่า พลังงานของคลื่น-แม่เหล็กไฟฟ้าจะเป็นสัดส่วนโดยตรงกับความถี่ของคลื่นนั้น
E = พลังงาน จูล (J)
h = ค่าคงที่ของพลังค์ มีค่า 6.625 x 10-34 จูลวินาที (Js)
= ความถี่ของคลื่นแม่เหล็กไฟฟ้า (Hz)
C = ความเร็วของคลื่นแม่เหล็กไฟฟ้าในสูญญากาศ = 3.0 x 108 m/s
= ความยาวคลื่น (m) (1 นาโนเมตร เท่ากับ 10-9 เมตร ) 
สเปกโตสโคป เป็นเครื่องมือสำหรับแยกสเปกตรัมของแสงขาว และตรวจเส้นสเปกตรัมของธาตุที่ถูกเผา การทดลองใช้ลวดนิโครมจุ่มลงในกรดไฮโดรลอริกเข้มข้น (HCI) แตะสารประกอบที่ต้องการทดสอบ นำไปเผาบนเปลวไฟ สังเกตสีของเปลวไฟ และใช้สเปกโตสโคปสังเกตสีของเส้นสเปกตรัม
1. สีของเปลวไฟ หรือเส้นสเปกตรัม เกิดจากส่วนที่เป็นโลหะ (ion +) ในสารประกอบชนิดนั้น ๆ
2. ธาตุแต่ละชนิด มีเส้นสเปกตรัมเป็นลักษณะเฉพาะตัวไม่ซ้ำกัน ลักษณะของเส้นสเปกตรัมจึงเป็นสมบัติเฉพาะตัวประการหนึ่งของธาตุ เส้นสีเขียวที่เห็นจากแสงไฟฟลูออเรสเซนต์ เกิดจาก ไอปรอท
2.1. การศึกษาเรื่องสเปกตรัมของสารหรือของธาตุ สรุปได้ว่า
2.1.1. เมื่ออิเล็กตรอนได้รับพลังงาน จึงขึ้นไปอยู่ในระดับพลังงานที่สูงขึ้น ทำให้อะตอมไม่เสถียร อิเล็กตรอนจึงคาย พลังงานเท่ากับพลังงานที่ได้รับเข้าไป พลังงานส่วนใหญ่ที่คายออกอยู่ในรูปของคลื่นแม่เหล็กไฟฟ้า ปรากฎเป็นเส้น สเปกตรัม
2.1.2. การเปลี่ยนระดับพลังงานของอิเล็กตรอน อาจมีการเปลี่ยนข้ามขั้นได้
2.1.3. อิเล็กตรอนในระดับพลังงานต่ำจะอยู่ใกล้นิวเคลียส
2.1.4. ระดับพลังงานต่ำอยู่ห่างกันมากกว่าระดับพลังงานสูง ระดับพลังงานยิ่งสูงขึ้นจะยิ่งอยู่ชิดกันมากขึ้น
2.2.. นีลส์ โบร์ สร้างแบบจำลองว่า อิเล็กตรอนในอะตอมวิ่งอยู่รอบนิวเคลียสเป็นชั้น ๆ หรือเป็นระดับพลังงานมีค่าพลังงานเฉพาะคล้าย ๆ กับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ ซึ่งแบบจำลองนี้ใช้ได้ดีกับอะตอมขนาดเล็กที่มีอิเล็กตรอนเดียว เช่น ไฮโดรเจนเท่านั้น

2.3 พลังงานไอออไนเซชัน (IE) คือ พลังงานปริมาณน้อยที่สุดที่ทำให้อิเล็กตรอนหลุดออกจากอะตอมในสถานะก๊าซ

2.3 พลังงานไอออไนเซชัน (IE) คือ พลังงานปริมาณน้อยที่สุดที่ทำให้อิเล็กตรอนหลุดออกจากอะตอมในสถานะก๊าซ
Mg(g) + IE1 Mg+(g) + e- , Mg+(g) + IE2 Mg2(g) + e-
พลังงานไอออไนเซชันลำดับที่หนึ่ง ไม่ว่าจะเป็นของธาตุใดก็ตาม ล้วนมีค่าต่ำสุดเมื่อเทียบกับพลังงานไอออไนเซชัน ลำดับอื่น ๆ ของธาตุเดียวกัน เพราะอิเล็กตรอนที่หลุดออกไปตัวแรกได้รับแรงดึงดูดจากนิวเคลียสน้อยที่สุด
ค่าพลังงานไอออไนเซชันใช้เป็นเกณฑ์ในการจัดกลุ่มอิเล็กตรอนได้
คำถาม กำหนดปฏิกิริยาต่อไปนี้
คำถาม กำหนดปฏิกิริยาต่อไปนี้
ก. Zn(s) Zn(g) ดูดพลังงาน 130 kj/mol
ข. Zn(s) Zn2+(aq) + 2e- ดูดพลังงาน 737 kj/mol
ค. Zn2+(g) Zn2+(aq) ดูดพลังงาน 2046 kj/mol
ผลรวมของค่าพลังงานไอออไนเซชันลำดับที่หนึ่ง และที่สองของสังกะสีเป็นเท่าใดในหน่วย kj/mol 1) 607 , 2) 1179 , 3) 1439 , *4) 2653
2.4 จำนวนอิเล็กตรอนที่มีได้มากที่สุดในแต่ละระดับพลังงาน = 2n2
2.4 จำนวนอิเล็กตรอนที่มีได้มากที่สุดในแต่ละระดับพลังงาน = 2n2
อิเล็กตรอนในระดับพลังงานสูงที่สุดของแต่ละธาตุ เรียกว่า เวเลนซ์อิเล็กตรอน 3919 K มีการจัดอิเล็กตรอน เป็น 2, 8, 8, 1 (หมู่ 1 A คาบ 4)
2.5 แบบจำลองอะตอมแบบกลุ่มหมอก สรุปได้ว่า
2.5 แบบจำลองอะตอมแบบกลุ่มหมอก สรุปได้ว่า
2.5.1. การเคลื่อนที่ของอิเล็กตรอนไม่มีทิศทางแน่นอน บอกได้เพียงโอกาสที่จะพบอิเล็กตรอน ณ ตำแหน่งต่าง ๆ เท่านั้น
2.5.2. โอกาสที่จะพบอิเล็กตรอนในแต่ละระดับพลังงานไม่เหมือนกัน ขึ้นกับจำนวนอิเล็กตรอนและระดับพลังงานของ อิเล็กตรอนนั้น
2.5.3. อิเล็กตรอนที่มีพลังงานต่ำอยู่ในบริเวณใกล้นิวเคลียสมากกว่าอิเล็กตรอนที่มีพลังงานสูง
อะตอม
อะตอม | ||||||
แบบจำลองอะตอมของฮีเลียม (ไม่ใช่อัตราส่วนจริง) ภาพนิวเคลียสซึ่งมีโปรตอน 2 ตัว(สีแดง) นิวตรอน 2 ตัว(สีเขียว) และ กลุ่มควันแสดง ความน่าจะเป็นของตำแหน่ง(สีเทา) ของอิเล็กตรอน(สีเหลือง) | ||||||
ประเภท | ||||||
| ||||||
คุณสมบัติ | ||||||
|
เป็นโครงสร้างขนาดเล็กมากมองด้วยตาเปล่าไม่เห็น ที่พบได้ในสิ่งของทุก ๆ อย่างรอบตัวเรา อะตอมประกอบไปด้วยอนุภาค 3 ชนิด คือ:
อิเล็กตรอน ซึ่งมีประจุลบโปรตอน ซึ่งมีประจุบวกนิวตรอน ซึ่งไม่มีประจุ
อิเล็กตรอน
อิเล็กตรอน (Electron) เป็นอนุภาคที่มีประจุไฟฟ้าเป็นลบวิ่งอยู่รอบๆ นิวเคลียส โดยปกติ จำนวน อิเล็กตรอน ในอะตอมที่เป็นกลางทางไฟฟ้าจะมีเท่ากับจำนวน โปรตอน เช่น ไฮโดรเจนมีโปรตอน 1 ตัว และอิเล็กตรอน 1 ตัว ฮีเลียมมีโปรตอน 2 ตัว และอิเล็กตรอน 2 ตัว
โปรตอน
โปรตอน (Proton) คืออนุภาคที่มีประจุไฟฟ้าเป็นบวกอยู่ในนิวเคลียสหรือใจกลางของธาตุ ธาตุเดียวกันจะมีจำนวนโปรตอนเท่ากัน เช่นไฮโดรเจนเป็นธาตุตัวที่ 1 เบาที่สุดมีโปรตอนตัวเดียว โปรตอนเกิดจากควาร์ก up 2 และ down 1 มีประจุ +1.60x10^(-19)คูลอมบ์ มีน้ำหนัก 1.67x10^(-27) กิโลกรัม ฮีเลียมมี 2 ตัว เหล็กมี 26 ตัว ยูเรเนียมมี 92 ตัว
นิวตรอน
นิวตรอน (Neutron) เป็นอนุภาคที่เป็นกลางไม่มีประจุไฟฟ้าอยู่ในนิวเคลียสมีจำนวนใกล้เคียงกับโปรตอนแต่อาจแตกต่างกันได้เช่นในฮีเลียมมีนิวตรอน 2 ตัว เท่ากับโปรตอนแต่ในเหล็กมี 30 ตัว และในยูเรเนียมมีนิวตรอนถึง 146 ตัว นิวตรอนอาจเกิดจากการอัดอีเล็กตรอนกับโปรตอนดังเช่นในดาวฤกษ์มวลมาก นิวตรอนเกิดจากควาร์ก up 1 อนุภาค และ ควาร์ก down 2 อนุภาค มีน้ำหนัก 1.67x10^(-27)ซึ่งเท่ากันโปรตอน
อะตอมเป็นองค์ประกอบพื้นฐานทางเคมีซึ่งไม่เปลี่ยนแปลงตามปฏิกิริยาเคมี ธาตุที่พบได้ตามธรรมชาติบนโลกนี้นั้นมีปรากฏอยู่ประมาณ 90 ชนิดเท่านั้น (นอกเหนือจากนี้มี ธาตุบางชนิดเช่น เทคนิเซียมและ แคลิฟอร์เนียม ที่พบได้ในซูเปอร์โนวา และธาตุที่เลขอะตอมสูง (มากกว่า 100 ขึ้นไป) ที่สามารถสังเคราะห์ได้จาก การนำอะตอมมาชนกันด้วยความเร็วสูง)
เราเรียกอะตอม สองอะตอมว่าเป็นธาตุเดียวกันก็ต่อเมื่อ อะตอมสองอันนั้นมีจำนวนโปรตอนเท่ากัน โดยทั่วไปแล้ว ธาตุแต่ละธาตุไม่เหมือนกัน อะตอมของธาตุชนิดเดียวกันอาจมีจำนวนนิวตรอนที่แตกต่างกัน เราเรียกสองอะตอมที่มีจำนวนโปรตรอนเท่ากันแต่จำนวนนิวตรอนแตกต่างกันนั้นจะเรียกว่าเป็นไอโซโทป (isotope)
นอกจากธาตุที่เกิดตามธรรมชาติแล้ว ยังมีธาตุที่ถูกสร้างขึ้น แต่ธาตุเหล่านี้มักจะไม่เสถียร และ สลายไปเป็นธาตุอื่นที่เสถียร โดยกระบวนการสลายกัมมันตรังสี ตัวอย่างเช่น Beta Decay, Double BetaDecay, Beta Capture, Gamma Decay และอื่น ๆ
ถึงแม้ว่าจะมีธาตุที่เกิดตามธรรมชาติเพียง 90 ชนิด อะตอมของธาตุเหล่านี้สามารถสร้างพันธะทางเคมี รวมกันเป็นโมเลกุล และองค์ประกอบชนิดอื่นๆ โมเลกุลเกิดจากการรวมตัวกันของอะตอมหลายอะตอม เช่น โมเลกุลของน้ำเกิดจากการรวมตัวกันของอะตอมไฮโดรเจน 2 อะตอม และ อะตอมออกซิเจน 1 อะตอม
เนื่องจากอะตอมเป็นสิ่งที่มีอยู่ไปทั่วทุกที่ จึงเป็นหัวข้อศึกษาที่ได้รับความสำคัญในหลายศตวรรษที่ผ่านมา หัวข้อวิจัยทางด้านอะตอมในปัจจุบันจะเน้นทางด้าน quantum effects เช่น ของเหลวผลควบแน่นโบส-ไอน์สไตน์
โครงสร้าง
แบบจำลองของอะตอมที่ได้รับการยอมรับมากที่สุดคือ แบบจำลองเชิงคลื่น (wave model) ซึ่งพัฒนามาจาก แบบจำลองของบอหร์ (Bohr model) โดยได้รวมเอาการค้นพบ และ พัฒนาการทางด้าน กลศาสตร์ควอนตัม (quantum mechanics) เข้าไปด้วย

The electron orbital wavefunctions ของไฮโดรเจน (hydrogen) เลขควอนตัมหลัก (principal quantum number) อยู่ทางขวาของแถวในแนวนอนแต่ละแถวและเลขควอนตัมเชิงมุม (azimuthal quantum number) ถูกแทนด้วยตัวอักษร (s, p และ d) ด้านบนของแต่ละ- แถวในแนวตั้ง (สดมภ์ หรือ column)
แบบจำลองเชิงคลื่นอย่างง่าย (ของ อิเล็กตรอน หรือ อะตอมของไฮโดรเจน) ตั้งอยู่บนสมมติฐานว่า ความน่าจะเป็นที่จะพบ อนุภาค สามารถที่จะถูกเขียนได้ด้วย ฟังก์ชันคลื่น (wavefunctions) ซึ่งจะต้อง สอดคล้องกับ สมการของชโรดิงเจอร์ (Schrodinger Equation) และหากอนุภาคนั้นเป็น อนุภาคสปินครึ่ง(เช่น อิเล็กตรอน, โปรตอน หรือ นิวตรอน) ฟังก์ชันคลื่นของ -อนุภาคนั้นต้องตกอยู่ภายใต้เงื่อนไข หลักการกีดกันของ เพาลี (Pauli Exclusion Principle) นั่นคือ ฟังก์ชันคลื่นต้องมีสมมาตรต่อต้าน (anti-symmetric) ภายใต้การสลับตำแหน่งของอนุภาคสองตัว
ซึ่งโดยสมมติฐานเหล่านี้ แบบจำลองเชิงคลื่นได้ ทำนาย ว่าอิเล็กตรอนของ ไฮโดรเจน นั้น
o สามารถมี Energy Level นั้น Quantized (นั่นคือ มีค่าได้เพียงบางค่าเท่านั้น)
o วงโคจรแต่ละวงนั้นสามารถมีอิเล็กตรอนได้อย่างมาก 2 ตัว และถูกควบคุมด้วย เลขควอนตัม (quantum number) 3 ตัว คือ principal, azimuthal, and magnetic
o อิเล็กตรอนแต่ละตัวนั้นจะมีเลขควอนตัมตัวที่ 4 เฉพาะตัว คือ spin
การที่จะใช้แบบจำลองเชิงคลื่นกับ อะตอมที่ซับซ้อนกว่า อะตอมของไฮโดรเจน นั้นค่อนข้างยากต่อการคำนวณเชิงวิเคราะห์ (Analytical calculation) เนื่องจากต้องเพิ่ม อันตรกิริยา หลายแบบ เข้าไปใน สมการของชโรดิงเจอร์ ยกตัวอย่างเช่น Spin-Orbit Coupling และ Electron-Electron interaction ซึ่งเป็นพจน์ที่ ไม่เป็นเชิงเส้น (Non-Linear) แต่การคำนวณเหล่านี้สามารถทำได้โดยใช้คอมพิวเตอร์ (computer) เช่น การคำนวณประมาณด้วยวิธีของฮาร์ทรี ฟ็อค (Hartree Fock method)
ขนาดอะตอม
ขนาดของอะตอมนั้นจะกำหนดได้ยาก เนื่องจากวงโคจรของอิเล็กตรอน (ความน่าจะเป็น) นั้น จะลดลงอย่างต่อเนื่องจนเป็นศูนย์นั่นคือ ไม่ว่าระยะทางจะไกลจากนิวเคลียสเท่าไรเรายังมี ความน่าจะเป็น (ที่ไม่เป็นศูนย์) ในการค้นพบอิเล็คตรอน ของอะตอมนั้น ในกรณีของอะตอมที่สามารถก่อตัวในรูปผลึกของแข็งนั้น ขนาดของอะตอมสามารถประมาณโดยใช้ระยะทางระหว่างอะตอมที่อยู่ติดกัน ส่วนอะตอมที่ไม่สามารถก่อตัวเป็นผลึกแข็งนั้น การหาขนาดจะใช้เทคนิคอื่นๆ รวมทั้งการคำนวณทางทฤษฎี โดยใช้ ค่าเฉลี่ยรากที่สอง (Root mean square) ของอิเล็คตรอน ตัวอย่างเช่น ขนาดของอะตอมไฮโดรเจนนั้นจะประมาณ 1.2×10-10m เมื่อเทียบกันขนาดของ-โปรตอนซึ่งเป็นเพียงอนุภาคในนิวเคลียส ซึ่งมีขนาดประมาณ 0.87×10-15m จะเห็นได้ว่าอัตราส่วนระหว่างขนาดของอะตอมไฮโดรเจน และ นิวเคลียสนั้นจะประมาณ 100,000 อะตอมของธาตุต่างชนิดกันนั้นจะมีขนาดต่างกัน แต่สัดส่วนของขนาดก็จะอยู่ในช่วงประมาณไม่เกิน 2 เท่า เหตุที่ขนาดไม่เท่ากันนั้นเนื่องมาจากนิวเคลียสที่มีจำนวนประจุบวกไม่เท่ากัน นิวเคลียสที่มีประจุบวกมากก็จะ-สามารถดึงดูดอิเล็กตรอนให้เข้าใกล้จุดศูนย์กลางได้มากขึ้น
ธาตุและไอโซโทป
อะตอมโดยทั่วไปแล้วจะแบ่งตามเลขอะตอม ซึ่งเท่ากับจำนวนโปรตอนในอะตอม เลขอะตอมจะเป็นตัวระบุว่าอะตอมนั้นเป็นอะตอมของธาตุอะไร ตัวอย่างเช่น อะตอมของคาร์บอน จะมีโปรตอน 6 ตัว อะตอมที่มีเลขอะตอมเท่ากันจะมีคุณสมบัติร่วมทางกายภาพหลายอย่างและจะมีคุณสมบัติทางเคมีที่เหมือนกัน ในตารางธาตุอะตอมจะถูกเรียงตามค่าเลขอะตอม
เลขมวล หรือเรียก เลขมวลอะตอม หรือ เลขนิวคลีออน ของธาตุคือ จำนวนรวมของโปรตอน และ นิวตรอนในอะตอม โปรตอนและนิวตรอนแต่ละตัวนั้นจะมีมวล 1 amu จำนวนนิวตรอนในอะตอมนั้นไม่ได้เป็นตัวกำหนดชนิดของธาตุ ธาตุแต่ละชนิดนั้นจะมีจำนวนโปรตอนและอิเล็กตรอนที่แน่นอน แต่อาจมีจำนวนนิวตรอนที่แตกต่างไปเรียกว่า ไอโซโทปของธาตุการ-เรียกชื่อของไอโซโทป นั้นจะขึ้นต้นด้วยชื่อของธาตุและตามด้วยเลขมวล ตัวอย่างเช่น อะตอมของ คาร์บอน-14 มีโปรตอน 6 ตัว และ นิวตรอน 8 ตัว รวมเป็นเลขมวล 14
อะตอม ที่เรียบง่ายที่สุดคืออะตอมของ ไฮโดรเจน มีเลขอะตอมเท่ากับ 1 และ มี โปรตอน 1 ตัว อิเล็กตรอน 1 ตัว ไอโซโทปของไฮโดรเจนซึ่งมีนิวตรอน 1 ตัวจะเรียกว่า ดิวทีเรียม หรือ ไฮโดรเจน-2 ไอโซโทปของไฮโดรเจนซึ่งมีนิวตรอน 2 ตัว จะเรียก ทริเทียม หรือ ไฮโดรเจน-3
เลขมวลอะตอมของธาตุที่ระบุในตารางธาตุ เป็นค่าเฉลี่ยมวลของไอโซโทปที่พบตามธรรมชาติ โดยเฉลี่ยแบบถ่วงน้ำหนักตามปริมาณที่ปรากฏในธรรมชาติ
แบบจำลองอะตอม
แบบจำลองอะตอมที่เป็นที่รู้จักดีมีอยู่ 5 แบบ คือ
1. แบบจำลองอะตอมของดอนตัลซึ่งมีลักษณะป็นทรงกลมและภายในว่างเปล่าไม่มีอะไรไม่สามารถทำให้สูญหายหรือเกิดขึ้นใหม่ได้
2. แบบจำลองอะตอมของทอมสันซึ่งภายในอะตอมมีโปรตอนและมีอิเล็กตรอนเท่าๆกันกระจัดกระจายอยู่ทั่วภายในอะตอม
3. แบบจำลองอะตอมของรัทเทอร์ฟอร์ดซึ่งภายในนิวเคลียสของอะตอมมีโปรตอนและนิวตรอนอยู่ภายในส่วนบริเวณนอกมีอิเล็กตรอนวิ่งอยู่รอบๆอย่างอิสระ
4. แบบจำลองอะตอมของโบร์ซึ่งภายในอะตอมจะมีชั้นพลังงานและแบ่งเป็นชั้นได้7ชั้นคือ k l m n o p q ตามลำดับซึ่งแต่ละระดับชั้นพลังงานก็จะมีพลังงานที่ไม่เท่ากัน
5. แบบจำลองอะตอมของกลุ่มหมอก ภายในตรงกลางนิวเคลียสจะเป็นโปรตอนและนิวตรอน ส่วนภายนอกเป็นกลุ่มหมอก ถ้ากลุ่มหมอกตรงบริเวณไหนมากก็แสดงว่าตรงนั้นมีโอกาสที่จะมีอิเล็กตรอนอยู่มากกว่าที่อื่นๆ
แบบจำลองอะตอมที่ได้รับการยอมรับมากที่สุดในปัจจุบันคือแบบจำลองอะตอมของกลุ่มหมอก
สมัครสมาชิก:
ความคิดเห็น (Atom)
จำนวนการดูหน้าเว็บรวม
คลังความรู้ต่างๆ
ยินดีต้อนรับผู้ที่เข้ามาเยี่ยมชมทั้งหลายครับ